【干货!!】到底怎么写MDR技术文件?
众所周知,CE MDR时代已经来临,小编了解到TUV 莱茵,TUV南德,德凯,BSI等几大公告机构已经开始陆续接单。目前已经有很多制造商已经开始筹备CE MDR认证,而且我们麦迪科早在今年2月份就率先帮助国内穿刺界一大型企业拿到了大中华区第一张无源IIa类CE证书,虽然MDR时代已经到来,但是对如何编写MDR技术文件所有企业确实很难有个清晰的概念,所以今天小编来详细跟大家说下MDR认证下技术文档编写的详细要求,后面会加上MDD CE技术文档的对比。
附录II上市前的技术文件内容及相应的关键点:
1. 器械说明与性能指标,包括变型和附件
1.1. 器械说明与性能指标
关键点:
1)MDR将新增UDI,SRN信息
2)MDR会加强器械的型号之间区别的描述,器械不同型号作用于不同部位的描述,功能上的差异等方面都需要详细阐述
3)MDR将会更加关注器械与器械之间联用的安全性及性能性
1.2 对前一代和类似器械的引用
关键点:产品的临床应用历史及等同对比器械的描述
2.制造商提供的信息
即:标签及说明书,以及在公司网站上相应的必要信息的链接
3. 设计与制造信息
体系需要根据ISO 13485要求的产品设计开发文档
4. 通用安全与性能要求
MDD中此部分为基本要求检查,MDR通用安全与性能要求为其细化,具体的可以看MDR法规的附录I部分
5. 风险利益分析和风险管理
依据ISO14971标准, MDR将更加关注风险控制措施对应的证据,比如检测报告,验证报告等
6. 产品验证与确认
6.1. 临床前和临床数据
6.1.1 生物相容性
生物相容性即根据ISO 10993系列标准来进行评价
6.1.2 物理、化学和微生物表征
产品专标及iso 11737系列标准,MDR将会要求企业的检测报告同ISO产品专标的贴合性
6.1.3 电气安全和电磁兼容性
有源器械EN 60601 系列标准
6.1.4 软件验证和确认
MDR法规要求带软件器械要求
6.1.5 稳定性,包括产品有效期
MDR要求对老化后前的产品做稳定性的测试
6.1.6 性能和安全性
产品专标,MDR将会要求企业的检测报告同ISO产品专标的贴合性
应包括可用性评估及测试,MDR对于可用性将会增强要求,要求企业形成更加合理的可用评估计划及报告
6.1.7 临床评价
临床评价根据Meddev 2.7/1 Revision 4指南
以下关键点供制造商参考:
a. 如果之前的等同路径是通过与同行对手器械的对比,公告机构将挑战制造商对同行对手器械技术文档的获取方式。依据MDR, 对于三类/植入器械,将需要与等同器械的制造商签订合约, 或证明可以获得等同器械技术文件的完全访问权限。在大多数情况下,是不可能访问专有信息的, 所以制造商将需要重新考虑其等同路径,是使用不同的临床证据, 还是使用自有器械来建立等同。
b. 对仅使用制造商自有器械(或与比较器械制造商签定合约)进行等同比对,MEDDEV2.7/1 4版中提供的生物学和临床等同的标准是非常明确的。但是, 技术标准则非常广泛,需要根据情况加以界定, 以涵盖正在评价的器械类型。
6.1.8 PMCF计划和PMCF评估报告或为何PMCF不适用的任何合理性根据MEDDEV 2.12/2rev.2指南
6.1.9 III类器械和植入式器械的安全和临床性能总结(SSCP)
指南文件:MDCG 2019-9 Summary of safety and clinical performance A guide for manufacturers andnotified bodies August 2019
附录III上市后监督的技术文件1.1 根据MDR第84条制定的上市后监督计划。
在上市后监督计划中,制造商应证明其履行MDR法规第83条中所述的义务。
制造商一般需要搜集以下信息来完成此部分内容:
销售统计
投诉数据
客户反馈调查
不良事件数据库(例如,MAUDE)
临床文献审查(即,定期实施文献检索协议)
PMCF评估新的和修订的监管要求和外部标准
生产阶段的CAPA 等
1.2 如第 86 条所述的 PSUR 和第 85 条的上市后监督报告。
MDR 第85条上市后监督报告I类器械制造商应编制一份上市后监管报告,总结根据从84条所述的上市后监管计划收集的数据的分析结果和结论,以及采取的任何预防和纠正措施的理由和说明。
MDR第86条定期安全性更新报告
IIa、IIb和III类器械制造商应针对各器械或类别或器械组编制定期安全性更新报告(PSUR),总结根据从第84 条所述的上市后监管计划收集的数据分析结果和结论,并对采取的任何预防和纠正措施提供理由和说明。在该器械的整个生命周期内,
PSUR 应列出:
(a) 收益风险测定的结论;
(b) PMCF 的主要问题;
(c) 器械的销售量和使用涉及器械的群体大小和其他特征评估,以及实际可行时器械的使用频率。IIb 和 III类器械的制造商应至少每年更新 PSUR。除非是定制器械,否则 PSUR应作为附录 II 和 III规定的技术文件的一部分。
MDR CE技术文档同MDD CE 技术文档对比表
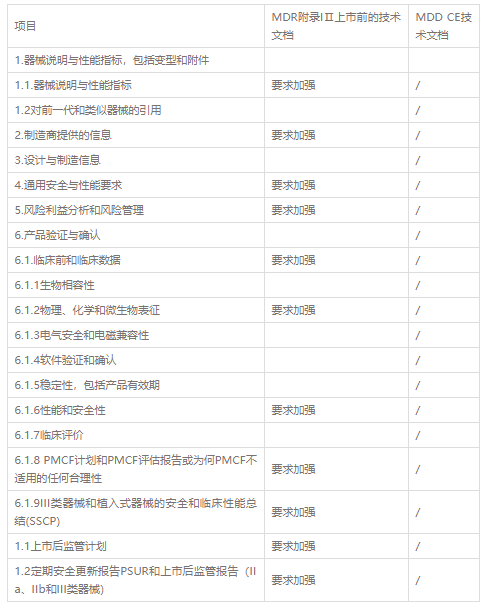
MDR CE技术文档是基于MDD CE技术文档的加强及升级,MDR法规强化了制造商的责任,拥有更加严格的上市前评审,适用的范围更加广泛,还大大的提高了透明度和可追溯性,也加强了警戒和市场的监管,强化了对公告机构的监督。
法规的升级对于制造商(特别是中小型企业)带来了巨大的冲击。加剧人才的稀缺:制造商、公告机构, 专家小组、欧盟授权代表等都需要熟悉法规、技术和的人员。
我们真心希望各企业能够尽早开始进行准备!
首先检查产品分类及符合性途径是否受影响!
公司内部进行自查,确保技术文件能够更新:
- 符合最新的技术要求; 特别是临床评价!
- 满足语言的要求
如果自身没有能力,一定要挑选一家稳定成熟有能力的咨询公司辅导。最后选择一家稳定、成熟的公告机构!这才是正确的应对MDR法规升级的最好方法。