Medical Device Regulation
欧盟正式发布了新版医疗器械法规MDR(EU 2017/745)。对于向欧盟销售医疗器械的制造商来说,这标志着MDR过渡期已开始。
医疗器械指令MDD(93/42/EEC)和有源植入医疗器械指令
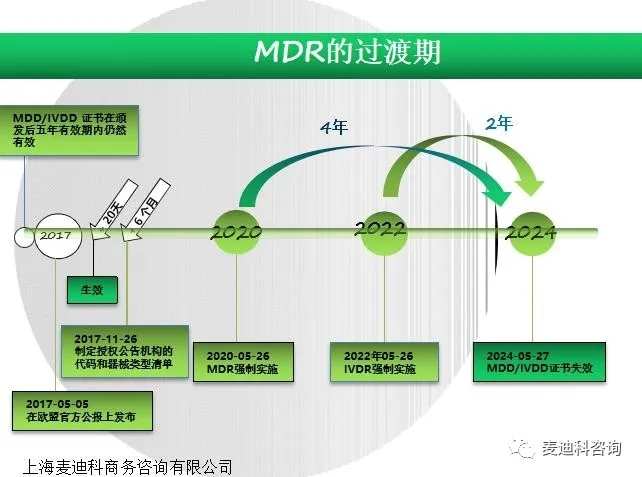
AIMDD(90/385/EEC)被医疗器械法规MDR(EU 2017/745)取代,法规过渡期设为3年,2020年5月26号将强制执行。现由于新冠病毒原因推迟一年至2021年5月26日执行。三年转换期之后就意味着MDD时代的终结。
新的MDR法规在MDD的基础上做了许多修订,对于医疗器械生产商来说,提交CE注册的时候很多文件仍是适用的,比如DoC和Risk Manual,但是也有更多的文件已经完全不适用,且对文件的要求更高了,对上市后的监管更严格了。
MDR相对于MDD可以说是一个颠覆性的变化,从名称MDD (Directive 指令)到MDR (Regulation,法规),就说明了欧盟把医疗器械的监管纳入了法律法规的范畴,不再是有商量余地的指令或指南。
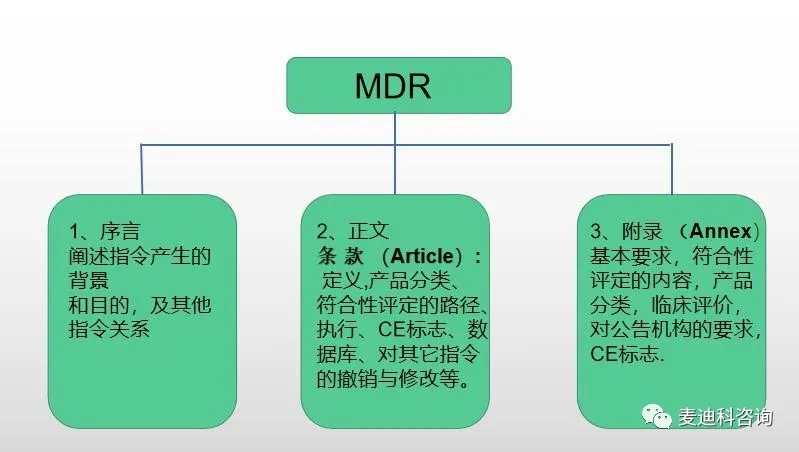
下面就MDR的架构,过渡期做简单介绍,不涉及具体内容的详细讨论。
如果您有医疗器械经营备案、注册、体系或临床方面的问题,麦迪科可为您提供专业的服务,以帮助您的产品及早进入国内外市场,面向全球。
以上内容仅供参考,一切以官方发布信息为准。