美国和欧盟医疗器械产品申报和质量体系实操培训
时间:5月27—28日
地点:中国上海市

一、背景BACKGROUND
如果您的产品已经在美国上市,但需要建立QSR820质量管理体系;
如果您的产品计划去美国上市,但不知道如何申报510(k);
如果您的产品计划去欧盟上市,但不知道如何申报CE认证以符合全新MDR规定。
二、培训目的:PURPOSE
为帮助企业更好地了解510(k)申报的流程和QSR820质量体系的要求,还有新版MDR对CE认证的要求和申报流程。上海麦迪科商务咨询有限公司定于2021年5月27至28日,在上海举办“美国和欧盟医疗器械产品申报和质量体系实操培训”,本次培训有请资深专家进行详尽的现场授课。我们在此诚挚邀请您届时莅临参与。
三、培训课程内容:
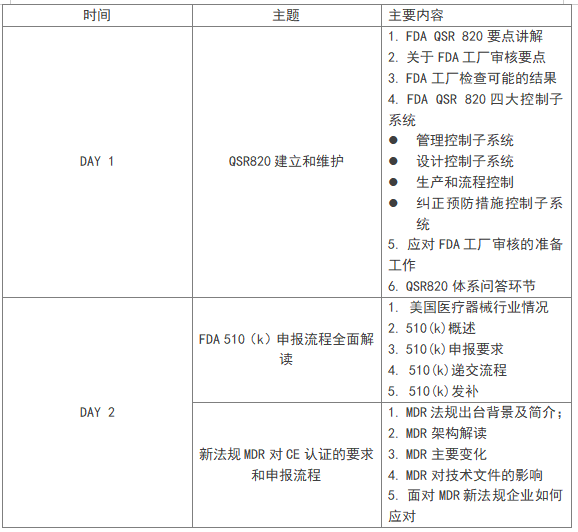
1. 美国医疗器械产品510(k)申报流程全面解读
2.美国医疗器械质量管理体系QSR820建立和维护
3. 新版MDR对CE认证的要求和申报流程
四、培训内容CONTENT
五、讲师介绍LECTURER
李仁富 (Keith Li):
15年以上业内从业经验,曾就任于GE(通用电气)供应商质量工程师, Intertek高级认证工程师, 美国UL 医疗器械事业部技术经理。
精通CE注册、FDA510k 注册、QSR820 体系、熟悉ISO14971风险管理和IEC62366可用性标准法规。审核及注册过100多家CE,FDA 510K,巴西ANVISA项目,助力客户取得9个产品的TUV南德颁发的MDR证书,辅导并协助百家企业完成QSR820审核,其中有八成是零缺陷通过。
六、培训对象TRAINING OBJECTS
医疗器械企业负责人、管理者代表、品质经理、法规专员、注册专员;医疗器械企业负责生产、技术、质量的管理者;对医疗器械国际市场有兴趣的人士等。
七、时间地点TIME AND LOCATION
培训时间:2021年5月27-28日
培训地点:报名后由主办方通知。
八、培训费用TRAINING FEES
本次培训费用:3000元/人(包含培训费、材料费、午餐费)
九、报名方式REGISTRATION METHOD
电话报名:15055335282 Eason(微信同号)
邮箱报名:eason.mu@mind-link.net
报名后由课程管理人员与报名者联系,确认课程报名完成,并完成后续费用交付等事宜。由于参课人数的限制,本课程无法预留未完成缴费的学员名额,由此带来的不便敬请谅解。
若有其他问题,请联系工作人员
九、付款及开票PAYMENT
如需开票,请付款后向课程管理员提供完整开票信息。
培训发票将于培训结束后7个工作日内开具寄出。
上海麦迪科商务咨询有限公司(http://www.mind-link.net)是一家集医械药品全球注册咨询、工厂审查陪审翻译和各国相关质量管理体系咨询、法规和培训服务为一体的专注技术咨询公司。
联系人:李老师
电话:18602107102
邮箱:keith.li@mind-link.net
微信:keith-018